こんにちは。
絶賛4日勤中のおまめです。
疲れ果ての果ての果て。よもやよもやです。笑
このお勉強記事について、最近難しい!と彼からご指摘いただきました。
私も難しいと思う。笑
私もわからないですもん。
この記事も全く需要ないのは分かってるんだけど、
それでも、しっかり徹底的に学んだことを書くことが、自分のアウトプットにもつながるし、
私みたく、血ガスわかんないんだよな〜って思っている看護師さんが、
1人でも「なんかイメージついたかも〜」って苦手意識が少しでも減ったら良いなと思っています。
この血ガスについては、私自身も苦手意識の塊です。まず、酸塩基平衡という言葉も嫌。
考えると頭使うし、アルカローシスだのアシドーシスだの、なんですの〜って思います笑笑。
今回のこの深堀も、ぶっちゃけしたくなかったです。笑
難しすぎて勉強したくなくて、前回スルーをしちゃいました。笑
でも、この深堀の内容を知っておくと、血ガスの結果から、患者さんのアシドーシスが急性なのか、慢性的なものなのかとかがわかって、「この患者さん状態危なくない?」っていうアセスメントに繋がるんですよ。
やはり、我々看護師は、プロとして患者さんのアセスメント、看護をすることが仕事であり、
ただ検査値が異常か正常かを判断できるだけではダメだと思うんですよね。
何がどうだめなのか、今後起こり得ることは何か、
この状態を打開するために何をすべきかまでを考えることが必要だと思うのです。
前置き長々とすみません!笑。
それでは深掘りしていきます!!!!!
ちなみに前回の投稿の続きなので、是非前回の投稿と合わせて読んでいただきたいです!
計算式を使って求めます!代償性変化の予測範囲?
呼吸性アシドーシス、アルカローシス、代謝性アシドーシス、アルカローシスになると、
代償の変化が起こると、前回の投稿で書いています!
おさらい☟
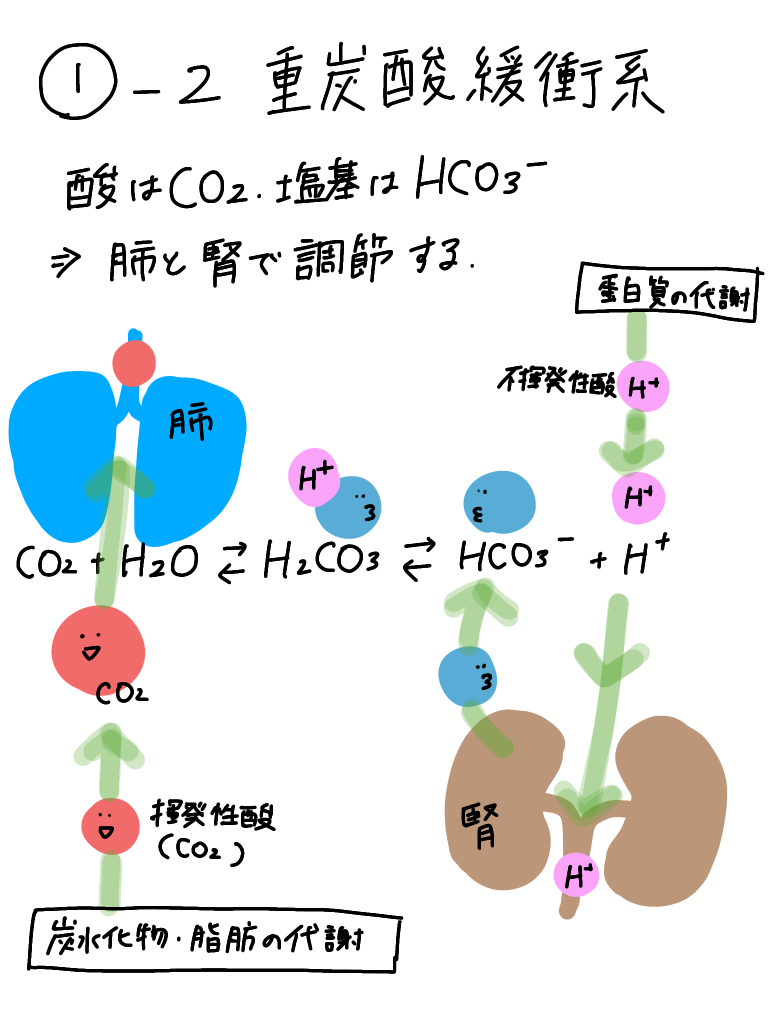
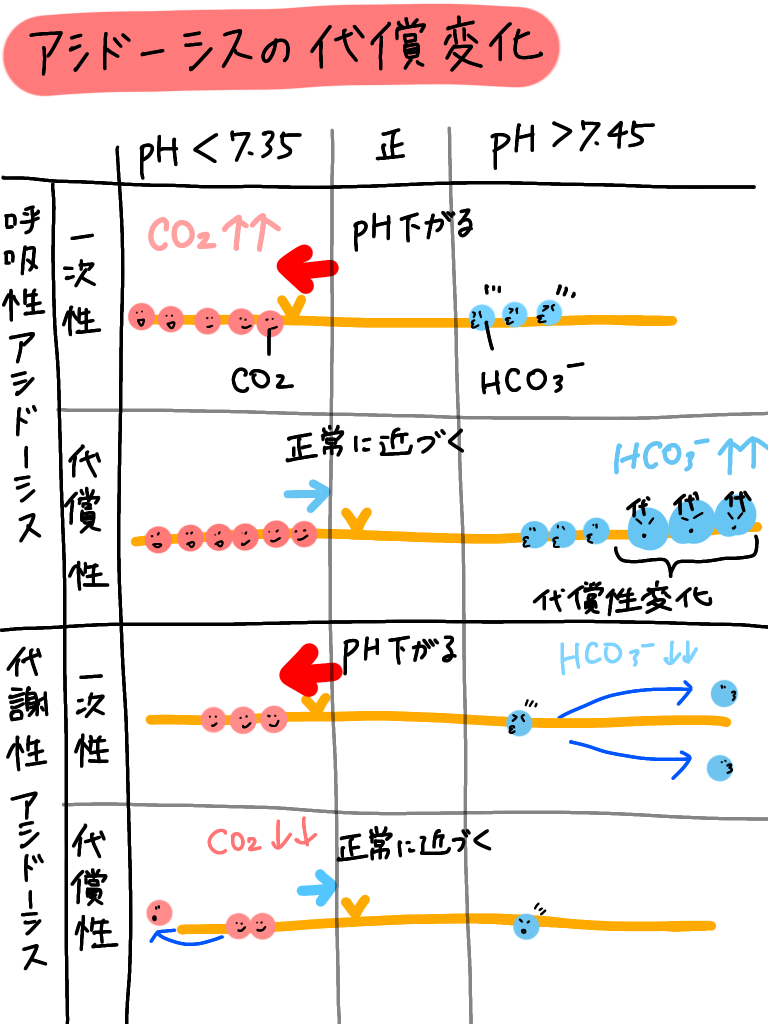
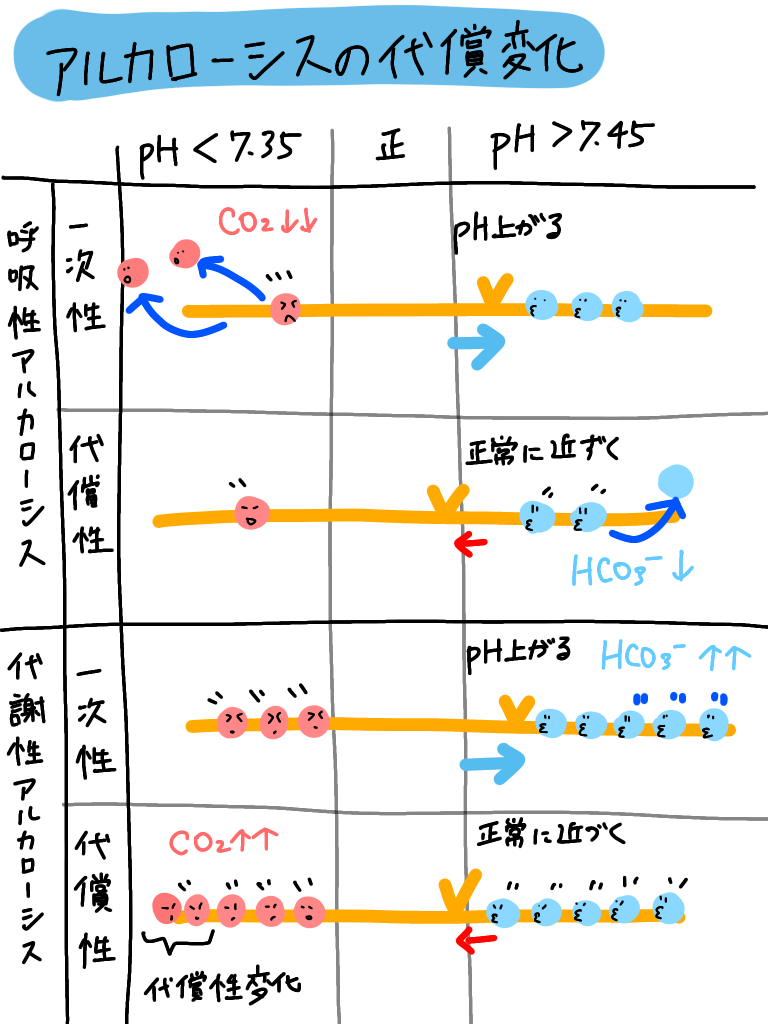
綱引きの容量で考えると上のようなイメージです!!
わかんないよ〜って人は是非前回の投稿を見てみてください!
例を挙げますと、
過呼吸になっちゃった〜!二酸化炭素がいっぱい体から出ていくと、酸が少なくなって呼吸性アルカローシス。
つまりアルカリ性に傾く!それを改善させるために、腎臓の代謝でなんとかしようと代償性の働きが起こる!ということです!
腎臓でHCO3−を減らすように動きます。
ツナを真ん中に戻そうと反対側が頑張るわけです!
この、代償性変化って具体的にどこまで代償してくれるわけ?っていうのを求める計算式があるのです!

この予測範囲内にあれば問題はないのですが、予測範囲を超えて代償してしまっている場合は、他の原因も合併している可能性があることがわかります。
実際に数字を使って計算してみましょう!
例
pH:7.5 PaCO2:70トール HCO3−:51
①正常から増加しているHCO3−の値を求めます。実測値ー正常値
=51−24=27
→27のHCO3−が増えて、アルカローシスになっている状態!とわかります。
②予測できるPaCO2の増加数を式に当てはめて計算します。
=0.7×27±5=13.9〜23.9
→つまり、正常のPaCO2から+13.9〜23.9くらいまで増加できますよ〜ってことなので、
40(正常PaCO2)+13.9〜23.9
=53.9〜63.9トール
③実測値と予測値の比較します。
実測値はPaCO2:70
予測値は53〜63であるため、予測範囲を超えてPaCO2が増えてしまってることがわかります!!!
この予測値より増加している場合は、呼吸性のアシドーシスを合併していることが考えられ、
逆に予測値よりも増加していない時は、少ない時は呼吸性アルカローシスを合併していうことが考えられます!
めちゃ難しいけど、理屈を理解できればすごいわかりやすいです!
この計算式は絶対に覚えられないので、その都度調べながらですけど笑。
患者さんのアセスメントに大変役立つと思われます!
代謝性アシドーシスの鑑別はアニオンギャップ(AG)?何それ?
結論!代謝性アシドーシスなら、AG値を計算してみよ!

この1番上の式で求められる値をアニオンギャップというそうです。笑
(看護師4年目で初見です笑)
体液中の陽イオンと陰イオンの濃さは中性を保つために基本的には等しいです。
通常測定されない陽イオンのことをUCって言うらしく、
通常測定されない陰イオンのことをUAと言うそうです。笑
そんなこんなで、二つ目のAG=UAーUCという式が成り立つようです!笑笑。
(わっかんね〜)
このAG値の正常が10〜14(12±2)
代謝性アシドーシスの鑑別では、AGが高い高AG性代謝性アシドーシスと、正常AG性(高Cl性)代謝性アシドーシスに分けることができるそうです!
まず、代謝性アシドーシスになるってどういうことだったか思い出してみてください!
代謝性=腎性
腎臓でアシドーシスになるのは、タンパク質などの分解で不揮発性酸が増加することと、下痢などでHCO3−が減った時です!
そのどっち?っていうのがこの計算式でわかるよ〜ってことです!!
酸が多くなってるのか、HCO3−が少なくなったのかがわかるということです!
①不揮発性酸が多くなると
前回の投稿を思い出して欲しいです!
新しく増えた酸がHAだとすると、A -とH+に分かれます!
増えたH +がHCO3 -とくっついて緩衝作用が起こることで酸塩基平衡を守っています。
→酸が水素イオンと得体の知れない陰イオンに分かれて増えていきます笑。
得体の知れない陰イオン=UA
UAが増えることでAGも増加することになります!
②HCO3 -が減ると
血中のHCO3 -が減ると、Clが増加するような仕組みになっているそうです!笑。
この場合、 UAは変化せずにClだけが増加することになります!
このことから、代謝性アシドーシスの場合、AG値を計算することで、
なんでこの状態になっているのかがわかります!
ケトアシドーシスや乳酸アシドーシス、薬物中毒、腎不全で余計な酸が体の中で増加しているのか、
それとも、下痢や副腎不全でHCO3 -が減ってしまっているのか!
患者さんの病態がわかっちゃいます!!!(すごい!)
全然計算しようという気にはなりませんが、きっとわかっていればいつか役立ちそう!笑。
おわり。



